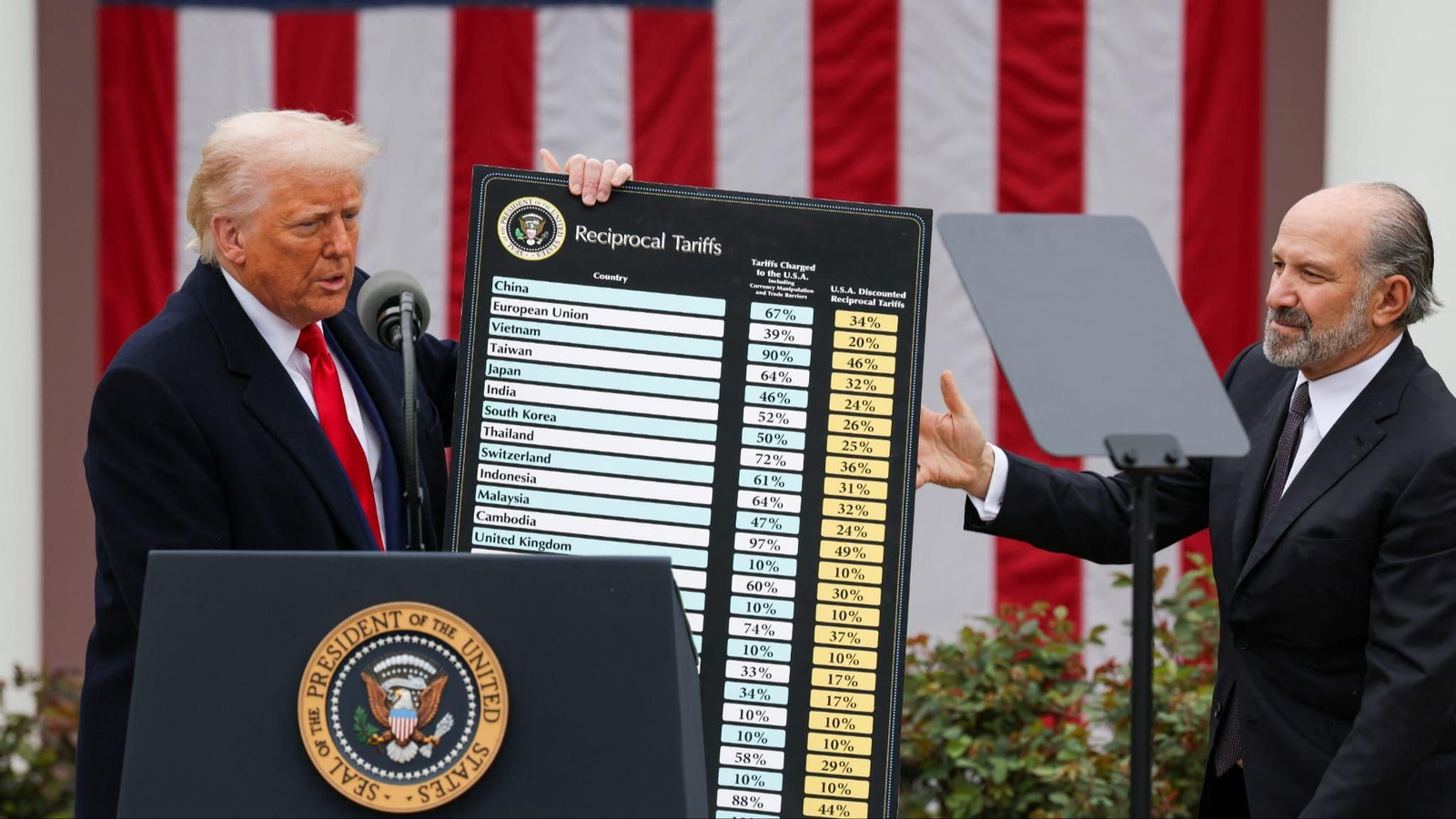
Moderna solicita permiso a EEUU y la UE para comercializar su vacuna
Según la compañía, el análisis de eficacia del estudio de fase 3 de la vacuna tuvo un 94,1%
La compañía farmacéutica Moderna anunció hoy que ha solicitado la autorización para comercializar su vacuna contra el coronavirus tanto a la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) como a la Agencia Europea del Medicamento.
Los reguladores analizarán los datos de prueba de la vacuna de ARNm y decidirán si es lo suficientemente segura y efectiva como para recomendar su implementación.
Según la compañía, el análisis de eficacia del estudio de fase 3 de la vacuna de Moderna incluyó a 30.000 participantes con una eficacia del 94,1%, con una tolerancia generalmente buena y sin que se hayan identificado problemas de seguridad graves hasta la fecha. El estudio de la fase 3 ha superado los 2 meses de seguimiento medio después de la vacunación, según lo exige la FDA de EE.UU para la autorización de uso de emergencia, dice la compañía en un comunicado.
Contenido patrocinado
También te puede interesar
Lo último
Sociedad de Promoción Exterior Principado de Asturias
Bruno López, director general de Asturex: “Exportar requiere paciencia, constancia y músculo económico”